Niels Bohr, 1885 ve 1962 yılları arasında yaşamış olan Danimarkalı ünlü fizikçi, atoma ve daha da önemlisi dünyaya bakış açımızı geliştirdiği atom modellemesi ile tamamen değiştirdi. Niels Bohr, söz konusu atomlar ya da daha küçük maddeler olduğunda, klasik fizik yasalarının geçerliliğini kaybettiğini fark etmişti. Sonrasında, o zamanlarda kabul görmüş olan Rutherford Atom Modeli’ni geliştirerek kuantum mekaniğinin temellerini attı.
Makaleye geçmeden önce Niels Bohr ‘un hayatı hakkında daha fazla bilgi için buraya tıklayın.
Atoma Farklı Bir Bakış Açısı
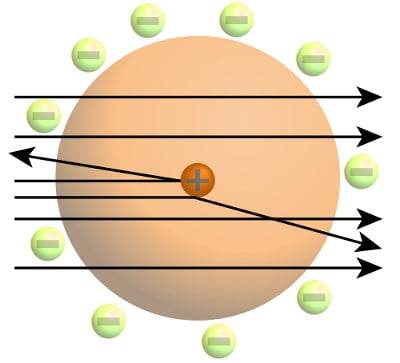
Kopenhag Üniversitesi’nde ders vermesini kesinleştirdiği zamanlarda, teorik fizik araştırmalarının odak noktası elektronların atomdaki yerini anlamlandırmaktı. Klasik fizik yasalarına göre Rutherford atom modelininde negatif yüklü elektronların enerji yayması ve pozitif yüklü çekirdeğe çekilmesi gerektiğini ve bu yüzden bu modelin klasik fizik yasaları ile çeliştiğinin farkındaydı. Hatta doktora tezini yazarken atomik ölçekteki davranışların klasik fizik yasaları ile açıklanabilmesinin imkansız olduğunu belirtmişti. Bu davranışı açıklayabilmek için Max Planck ve Albert Einstein tarafından yeni ortaya atılmış olan kuantum fiziğine yöneldi. 1912’de Manchester’da bu yöndeki çalışmalarına başladı.
Kuantum fiziği, bir cisim ısı ya da ışık yaymaya başladığı zaman sebep olduğu emisyonun bütün dalga boylarını içeren “sürekli” bir spektrumdan ziyade farklı dalga boylarından oluşan “paketler” halinde bulunduğunu savunur. Einstein bu “paketler”i fotonlar olarak adlandırmıştır. Bütün dalgalar gibi, fotonlar da belirli bir hıza, frekansa ve dalga boyuna sahiptirler. Plank, bir fotonun sahip olduğu enerjinin sadece iki sayıyı çarparak bulunabileceğini fark etti: ışığın frekansı ve şimdilerde Plank sabiti denilen bir sayı. Kendisinin oluşturduğu bu denklem aşağıdaki gibidir:
E = hf E: enerji, h: Plank sabiti, ve f: frekans
Anlaşılabileceği üzere, bir fotonun sahip olabileceği enerji Plank sabitinin katlarından oluşur ve diğer enerjiler yasaklanmıştır. Kısacası, kuantum teorisinin özü şudur: ışık sadece belirli katsayılardaki enerjiye sahip olabilir ve diğer enerjilere sahip olamazlar.
Bohr her ne kadar uğraşmış olursa olsun;
Elektronun atom içindeki davranışını kuantum teorisi ile açıklamayı başaramadı. O zamana kadar iş arkadaşlarıyla yaptığı fikir alışverişleri, literatür taramaları ve kendi çalışmaları dahil olmak üzere hiçbir sonuca ulaşamadı. Ancak, 1913’ün şubat ayında Balmer Serisi’ni ve Balmer Formülü’nü duymasıyla birlikte, ileride kendisine Nobel Ödülü kazandıracak olan çalışmasına başlamıştı.

1885 yılında İsviçreli matematikçi Johann Balmer, sıcak hidrojenin yaydığı ışığın dalga boylarını ve dolayısıyla renklerini tahmin edebilen matematiksel bir formülü keşfetti. Aslında, bu formül herhangi bir açıdan teorik bir temeli bulunmuyordu. Ancak formül çalışıyordu! Bohr, E = hf ilişkisinin elektronların davranışını açıklamada çok önemli ve merkezi bir yere sahip olduğunu öne sürdü.
Elektronların enerjisinin de aynı ışık enerjisi gibi farklı enerji paketleri halinde geldiğini savundu. Sadece belirli enerji seviyelerinde elektronların bulunabileceğini ve bu seviyelerin hidrojen atomu için Balmer’in formülü ile hesaplanabileceğini ileri sürdü. Balmer’in formülüne, Plank’ın formülünü entegre edip elektronun kütlesi ve yükü gibi önemli sayıları da ekleyerek bir formül geliştirdi. En basit hali ile, elde ettiği matematiksel sonuç, atomun küçük bir güneş sistemi olduğuydu. Gezegenlerin güneş etrafında dönmesi gibi, elektronlar da çekirdeğin etrafında belirli yörüngelerde dönüyor ve bir elektron çekirdekten ne kadar uzakta ise enerjisi o kadar yüksek oluyordu. Ancak, gezegenlerin aksine, birden fazla elektron çekirdek etrafında aynı yörüngede bulunabilirdi.
Bu şekilde Bohr, Balmer’in formülünün neden çalıştığını “yeni” kuantum teorisini kullanarak tüm dünyaya gösterdi ve kuantum mekaniğinin (atom ölçekli nesnelerin fiziği) babası olarak anılmaya bu şekilde başladı.
Eski Probleme Yeni Çözüm
Uzun zamandır bilim insanlarında merak uyandıran maddenin ışığı nasıl emip yayabileceği sorusu Bohr’un yeni atom modeli ile açıklığa kavuştu. Bohr, elektronların sadece belirli yörüngelerde bulunabileceğini, ancak ışığı emerek daha düşük enerji seviyesinden daha yüksek enerji seviyesine geçebileceğini, ve bunun tam tersinin de ışığı yayarak yapabileceğini savundu.
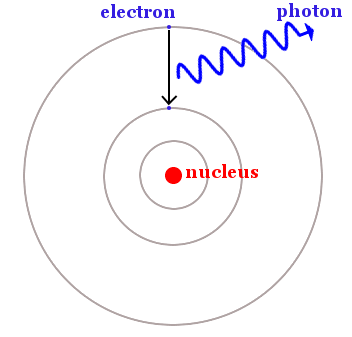
Klasik fizik kurallarına göre elektronlar herhangi bir sayıda enerjiye sahip olabilir. Fakat, “yeni” kuantum fiziğinde elektronlar, sabit enerjinin tanımlanmış yörüngeleriyle sınırlıydı. Diğer elektron enerjilerine ise sahip olmaları yasaktı. Bir elektron enerjiyi absorbe ettiğinde, bir kuantum sıçraması gerçekleştirir: bir yörüngeden kaybolurken, yasak olmayan daha yüksek bir yörüngede geçiş yapar. Aynı şekilde, bir elektron enerji kaybettiğinde daha yüksek enerji yörüngesinden kaybolurken, yasak bölge ile ayrılmış daha düşük enerji yörüngesine geçiş yapar.
Kuantum teorisi elektronların neden çekirdeğe doğru çekilirken enerji yayılımı yapmadığına olan yanıtı aslında çok basittir. Çekirdek, bir elektron için izin verilen bir enerji yörüngesi değildir. Kuantum teorisi ayrıca, emisyon spektrumunda bulunan yoğun renklerin atomlardaki elektron yörüngelerinin enerjileri ile ilişkili olduğunu göstererek, atomların spektrumlarını da açıklığa kavuşturdu.

Kuantum Kimyasının Kuruluşu
Bohr, elementlerin kimyasal özelliklerini belirleyen yegane sebebin, en yüksek kararlı yörüngeyi işgal eden elektronların (değerlik elektronları) davranışından kaynaklandığını gösterdi. Bunu yaparken, periyodik tablonun yapısının çoğunu açıklamayı başardı ve yeni bir bilimsel disiplin kuruldu – kuantum kimyası.
Bohr, Atom Anlayışımızı Kuantum Sıçrayışıyla İleriye Taşıyor
1912’de Rutherford’un atom modeli hala bilim camiası tarafından kabul görmemişti. Ancak, 1913’te Bohr, elektronların davranışını belirleyebilmek için matematiği, fizik alanındaki güçlü sezgisi ile birleştirmiş ve sonucunda ise çekirdeğin etrafında önceden belirlenmiş ve izin verilen yörüngelerde ilerlediğini göstermiştir. Bohr’un oluşturduğu atom modeli aslında Rutherford’un atom modelinin geliştirilmiş halidir. Atomun Rutherford-Bohr modeli hala liselerde öğretilmeye devam ediyor. 1920ler’de ise, Werner Heisenberg ve Erwin Schrödinger elektronun atomdaki yerine ilişkin çok daha gelişmiş bir bakış açısı kazandırdı bilim camiasına.
Her ne kadar, Bohr’un atom modeli geçerliliğini sadece bir elektrona sahip olan atomlarda (hidrojen ve iyonize olmuş helyum) korusa da, kuantum teorisini atomik ölçekte kullanılabilecek bir teori olduğunu kanıtladı. Bohr, sonsuz bir okyanusa açılan kapıyı aralayan kişiydi. Kısa süre içinde bu kuantum adı verilen okyanus, çalışkan ve zeki fizikçilerin akınına uğradı. Rutherford ile mektuplaşmaları sırasında bu durumu şu sözlerle dile getirdi: “Bu alanda kimse çalışmıyorken, bir anda birçok insan bu alana yöneldi ve neredeyse herkesin çok çalıştığı bir alana dönüştü.
Bohr’a Talep
Bohr, 1913’te üç ünlü kuantum makalesi yayınladı. Tabii, bu dönemde bir fizikçi olarak da kendi ünündeki sıçramanın keyfini çıkarıyordu. Matematiksel evrenin merkezi olan Almanya’daki Göttingen Üniversitesi’nde seminerler verdi ve Ernest Rutherford’un Manchester’a kıdemli bir akademik araştırma görevinde dönme teklifini kabul etti. Ne yazık ki 1914 yılında başlayan ve 1918 yılının sonuna kadar devam eden I.Dünya Savaşı, araştırmalarını da kötü etkiledi. Bohr 1914-1916 yılları arasında Manchester’da çalışmaya devam etti.
Sonrasında, Kopenhag’a dönüp orada üniversitenin ilk teorik fizik başkanı oldu. Üniversiteye bağlı ve Rutherford’un araştırma grubunu örnek alacak olan teorik fizik araştırma enstitüsünü kurmak için para topladı. Werner Heisenberg ve “yeni” kuantum mekaniğinin gelecekteki mimarları olan birçok bilim insanları, Bohr’un liderliğinde Kopenhag’da kendilerini geliştirme fırsatı buldular. Bugün Niels Bohr Enstitüsü, fizik bilimlerinin ön saflarında faaliyet göstermeye devam ediyor.
Nobel Ödülü
Bohr, 1913’te yaptığı çalışmalardan dolayı 1922 Nobel Fizik Ödülü’ne layık görüldü.
Kopenhag’ın Quantum Mekanik Yorumu
Kuantum mekaniğinin gelişmesi ile birlikte nasıl yorumlanması gerektiğine dair görüşler de hızla artmaya başladı. Her ne kadar Einstein ve Bohr fiziğe dair birçok konuda anlaşıyor, ufuk açıcı tartışmalara giriyor olsalar da kuantum konusundaki fikirleri birbirinden çok farklıydı. Aralarında en çok tartıştıkları konunun odak noktası ise Einstein’in deyimiyle Tanrı’nın evrenle zar atıp atmadığıydı. Einstein’ın cevabı hayır iken, Bohr’un bu soruya cevabı evet idi. Bohr’un “Tanrı’nın evren ile zar attığı” savı şu anda dünyadaki fizikçilerin büyük bir kısmı tarafından kabul edilmektedir.

Atomik ölçekteki dünyayı klasik fizik yasalarına göre yorumlamaya çalışan herkese garip görünmesi normal bir durumdur. Işığı dalga ve elektronları parçacık olarak kabul etsek bile ışığın parçacık, elektronun ise dalga gibi davranabileceği bir dünyadan bahsediyoruz aslında. Dahası, tek bir nötronun birkaç santim uzakta olan iki farklı yerde aynı anda bulunabilmesi de mümkündür. Yine aynı mantıkla, bir kedinin aynı anda hem canlı hem de ölü olarak bulunabildiği bir dünyadır. Bohr’un enstitüsünde çalışan Pauli, Bohr ve Heisenberg arasında arabuluculuk yapmak zorunda kalıyordu.
Çünkü zaman zaman kuantum dünyasının nasıl yorumlanması gerektiği konusunda o kadar şiddetli bir şekilde anlaşmazlığa düşüyorlardır ki, birbirleriyle zar zor konuşabiliyorlardı. Bu tartışmalara rağmen, 20. Yüzyılın fizik alanındaki üç devi (Niels Bohr, Werner Heisenberg ve Wolfgang Pauli), sonrasında “Kopenhag’ın Quantum Mekanik Yorumu” olarak adlandırılacak olan görüşlerin şekillenmesinde büyük rol oynadılar. Bu yorumu oluşturan dört önemli fikir ortaya atılmıştır.
Bu fikirler şu şekilde sıralanabilir:
- Bohr’un tamamlayıcılık ilkesi / Heisenberg’in belirsizlik ilkesi,
- Dalga-parçacık ikiliği,
- Dalga fonksiyonlarının olasılık kullanarak yorumlanması
- Karşılıklılık ilkesi; kuantum mekaniğinin klasik mekaniğiyle daha büyük kuantum sayılarında birleştirilmesi.
Kopenhag yorumunun felsefi çıkarımları ne olursa olsun kesin olarak bildiğimiz şey, kuantum mekaniğinin yöntemlerinin pratikte çalıştığıdır. Birçok felsefi çıkarımları bulunan bu yorumuma en güzel örneklerinden bir tanesi, siz gerçekliği aramadığınız sürece, onun var olmadığıdır. Özetle, kuantum mekaniği, evrenin atom ölçeğinde nasıl çalıştığını anlamak için şu ana kadarki sahip olduğumuz en güçlü araçtır.
Bileşik Çekirdek
1932’de, James Chadwick’in Rutherford’un laboratuvarında nötronu keşfetmesi ile Bohr dikkatini elektronlardan atom çekirdeğine çevirdi. Nükleer reaksiyonlar, özellikle de atom çekirdeklerinin nötronlarla bombardıman edilmesiyle ortaya çıkan “yeni” radyoaktif çekirdek reaksiyonları (nötron yakalama reaksiyonları), onu büyülüyordu. Daha önce bu konuda çalışmış olan diğer fizikçilerin nötron yakalamayı açıklama girişimlerinden memnun kalmayan Bohr, 1934 ve 1935’te formüle ettiği “bileşik çekirdek teorisini” 1936’da yayınladı.
Bu teoriye göre, bir nötron bir çekirdeğe girdiğinde, sadece bir nötron ya da protonla değil, çekirdeğin içinde bulunan birçok nötron ve protonlarla tekrar tekrar çarpışmaya başlar. Bunun sonucunda ortaya çıkan, yarı kararlı bileşik çekirdektir. Bu yarı kararlı bileşik çekirdek, çarpışmaların sonucunda, elde ettiği yüksek enerjiyi kararlı hale tekrardan geçebilmek için, nötron kaybetmesi veya gama ışınları yayması gibi çeşitli yollar ile başarır. Bohr’un teorisi, 1950’lerde oğlu Aage’nin, çekirdek ve nükleer reaksiyonların gelişmiş bir modelini formülize etmesinde anahtar rol oynayana kadar, sonraki yirmi yıl boyunca fizik dünyasının merkezde kaldı.
Bir Damla Sıvı Olarak Çekirdek

1939’da Niels Bohr ve John Archibald Wheeler, sıvı damla modelini üretmek için işbirliği yaptı. Bu model, çekirdeği yüzey gerilimi ile bir arada tutulan sıkıştırılamaz sıvının dönen bir damlası olarak modellendi. Yandaki şekilde de görebileceği üzere, atom çekirdeği küçük bir su damlası olarak modellendi. Şekli yuvarlaktır ve bu şekil deforme edilebilir.[Metin Kaydırma Sonu] Bir damla sıvının temel küresel şekli deforme olabilir ve büyük bir damla sıvı iki yeni damlaya bölünebilir. Benzer şekilde, uranyum gibi büyük bir atom çekirdeği, iki yeni atom çekirdeği oluşturmak için parçalanabilir ve buna nükleer fisyon denir. Nükleer fisyon ile açığa çıkan enerji, uranyum atom bombasının ve uranyum santrallerinin arkasındaki enerji kaynağıdır. Sıvı damlacığı modeli, uranyum gibi ağır çekirdeğe sahip olan atomları anlamlandıran başarılı bir model olarak kabul edilmekteydi.
Manhattan Projesi
1940’ın nisan ayında, Danimarka Nazi Almanyası tarafından işgal edildi. Bu durum aslında Bohr için ciddi bir problem teşkil ediyordu çünkü Bohr’un annesi yahudi olduğu için, kendisi de Nazi Almanyası tarafından yahudi olarak tanınıyordu. Her ne kadar ilk başlarda herhangi bir problem ile karşılaşmamış olsada, 1943’ün eylül ayında Naziler, Danimarkalı yahudileri toplama kamplarına taşımaya karar verdiler. Sonrasında, Nazilerin kendisini ve ailesini tutuklamak istediğine dair bir ihbar aldı. Bunun üzerine, Bohr ailesi, Danimarka’yı İsveç’ten ayıran bir nehrin üzerinden balıkçı teknelerine binerek Danimarka’yı terk etmek zorunda kaldılar. İsveç tarafsız ve henüz Naziler tarafından işgal edilmemiş olduğu için, Danimarka’daki 7000’e yakın Yahudinin neredeyse tamamı 1943’te İsveç’e kaçtı.

Ekim 1943’te, Niels ve oğlu Aage bir hafta arayla, İsveç’ten Nazi işgali altındaki Norveç üzerinden İngiltere’ye uçtu. O sılarda 58 yaşında olan Niels, normalde uçağa bombaların konuldu yerde seyahat etmek zorunda kaldı ve uçuş sırasında oksijen kaynağında çıkan bir problem sebebiyle yeteri kadar oksijen alamadı ve bilincini kaybetti. Bohr ile iletişiminin kesildiğini fark eden pilot, bir problem olduğunu anladı ve uçağı daha düşük bir yüksekliğe indirdi. Neyse ki, İsveç’e indikleri zaman bilincini tekrar kazanmıştı.
Oğlu da aynı şekilde bir savaş uçağında uçuşunu tamamlamak zorunda kaldı. Margrethe Bohr ise (Niels Bohr’un eşi), savaş bitene kadar İsveç’te kaldı. Birleşik Krallık’a güvenli bir şekilde ulaşan baba-oğul, İngiliz Hükümeti için başlatılan ve James Chadwick başkanlığındaki atom bombası projesinde çalışmaya başladılar. 1944’te baba ve oğul Manhattan Projesi’ne dahil oldu ve Londra’nın yanı sıra Amerika’da da sık sık zaman geçirdiler. Amerika’daki varlıklarını gizli tutmak için “Nicholas Baker” ve “James Baker” isimleri altında seyahat ettiler.
Bazı Kişisel Bilgiler ve Son
Bohr, 1912’de Kopenhag’da Margrethe Nørlund ile evlendi ve 6 çocukları oldu. Aage Bohr, oğullarından biri, Nobel Fizik Ödülü kazanarak, babasının izinden ilerdi. Niels Bohr, 18 Kasım 1962’de Kopenhag’daki evinde 77 yaşında ani kalp yetmezliğinden öldü. Külleri, Kopenhag’ın Assistens Mezarlığı’na, ebeveynleri ve kardeşi Harald’ın mezarlarının yakınına gömüldü. Margrethe’nin külleri de öldüğünde aynı yere gömüldü.
Çeviri: Hande Özge Aydoğan
Bunlar da ilginizi çekebilir
En Ünlü Fizikçiler ve Buluşları Listesi








Yorumlar 1